Basa-basinya garing ya? hehehe, harap dimaklumi yah, karena admin lagi agak ngantuk, semalam abis begadang di tempat Teteh Yuli yang kemarin baru nyunatin anaknya. Berhubung banyaknya inbok yang masuk menanyakan tentang Laju Reaksi adalah maka dengan sangat senang hati admin akan membahasanya. Nah, sambil seruput kopi, yuk simak ulasan lengkapnya dibawah ini.
Pembabaran Lengkap Laju Reaksi adalah
Selamat datang di Pakdosen.co.id, web digital berbagi ilmu pengetahuan. Kali ini PakDosen akan membahas tentang Laju Reaksi? Mungkin anda pernah mendengar kata Laju Reaksi? Disini PakDosen membahas secara rinci tentang Pengertian, rumus, persamaan, faktor, orde dan contoh soal. Simak Penjelasan berikut secara seksama, jangan sampai ketinggalan.
Pengertian Laju Reaksi
Laju reaksi atau kecepatan reaksi menyatakan banyaknya reaksi kimia yang berlangsung per satuan waktu. Laju reaksi menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap detik reaksi. Perkaratan besi merupakan contoh reaksi kimia yang berlangsung lambat, sedangkan peledakan mesiu atau kembang api adalah contoh reaksi yang cepat.
Laju reaksi adalah laju penurunan reaktan (pereaksi) atau laju bertambahnya produk (hasil reaksi). Laju reaksi ini juga menggambarkan cepat lambatnya suatu reaksi kimia, sedangkan reaksi kimia merupakan proses mengubah suatu zat (pereaksi) menjadi zat baru yang disebut dengan produk.
Rumus Laju Reaksi
Sebuah reaksi mengandung reaktan A dan reaktan B yang akan membentuk produk C dan D. Rumus laju reaksi akan saya jelaskan melalui rujukan persamaan berikut ini. Reaktan A dan B akan mempunyai jumlah molekul yang semakin usang berkurang, sedangkan produk C dan D akan mempunyai jumlah molekul yang semakin bertambah. Jika dinyatakan dalam bentuk rumus persamaan laju reaksi, maka akan menjadi menyerupai di bawah ini:
Dalam rumus laju reaksi di atas terdapat reaktan A dan B yang mengalami perubahan konsentrasi, maka dari itu diberikan tanda negatif sehingga nilainya akan menjadi positif. Untuk itu laju reaksi yaitu besaran yang harus selalu bernilai positif. Laju reaksi mempunyai satuan yaitu mol L⁻¹ s⁻¹ atau M s⁻¹.
Persamaan Laju Reaksi
Selain rumus laju reaksi di atas, saya juga akan menjelaskan wacana persamaan laju reaksi. Dalam sebuah reaksi kimia terdapat persamaan menyerupai berikut ini:
ɑA + bB → pP + qQ
Kemudian laju reaksi mempunyai hubungan dengan Molaritas yang dinyatakan dalam bentuk persamaan di bawah ini:
v = k[A]ⁿ[B]ᵐ
Keterangan :
v = Laju reaksi
k = Konstanta laju reaksi
n = Orde reaksi zat B
m = Orde reaksi zat A
Faktor yang Mempengaruhi Laju Rekasi
Laju reaksi dipengaruhi oleh beberapa faktor, antara lain :
-
Luas Permukaan Sentuh
Luas permukaan sentuh memiliki peranan yang sangat penting dalam banyak,sehingga menyebabkan laju reaksi semakin cepat. Begitu juga, apabila semakinkecil luas permukaan bidang sentuh, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil.
Karakteristik kepingan yang direaksikan juga turut berpengaruh, yaitu semakin halus kepingan itu, maka semakin cepat waktu yang dibutuhkan untuk bereaksi; sedangkan semakin kasar kepingan itu, maka semakin lama waktu yang dibutuhkan untuk bereaksi.
-
Suhu
Suhu juga turut berperan dalam mempengaruhi laju reaksi. Apabila suhu padasuatu reaksi yang berlangusng dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan lajureaksi semakin besar. Sebaliknya, apabila suhu diturunkan, maka partikel semakin tak aktif, sehingga laju reaksi semakin kecil.
-
Katalis
Katalisadalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi padasuhu lebih rendah akibat perubahan yang dipicunya terhadappereaksi. Katalis menyediakan suatu jalur pilihan denganenergi aktivasiyang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi. Katalis dapat dibedakan ke dalam dua golongan utama : katalis homogen dan katalis heterogen.
Katalis heterogen adalah katalis yang ada dalam fase berbedadengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama. Satu contoh sederhana untuk katalisis heterogenyaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerat. Ikatan dalam substrat-substrat menjadilemah sedemikian sehingga memadai terbentuknya produk baru. Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas. Katalis homogen umumnya bereaksi satu atau lebih pereaksi untuk membentuk suatu perantarakimiayang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut inimerupakan skema umum reaksi katalitik , dimana C melambangkan katalisnya :
Α│C→ΑC … (1)
B│ΑC→ΑB,C… (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkankembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi :
Α│B│C→ΑB,C
Beberapa katalis yang pernah dikembangkan antara lain berupa katalis Ziegler- Nattayang digunakan untuk produksi masal polietilen dan polipropilen. Reaksi katalitis yang paling dikenal adalah proses Haber ,yaitu sintesisamonia.
Menggunakan besi biasa sebagai katalis. Konverter katalitik yang dapatmenghancurkan produk emisi kendaraan yang paling sulit diatasi, terbuat dari platina danrodium.
-
Molaritas
Molaritas adalahbanyaknya mol zat terlarut tiap satuan volum zat pelarut.Hubungannya dengan laju reaksi adalah bahwa semakin besar molaritas suatu zat,makasemakin cepat suatu reaksi berlangsung. Dengan demikian pada molaritasyang rendah suatu reaksi akan berjalan lebih lambat daripada molaritas yang tinggi 5. KonsentrasiKarena persamaan laju reaksi didefinisikan dalam bentuk konsentrsi reaktan makadengan naiknya konsentrasi maka naik pula kecepatan reaksinya. Artinya semakintinggi konsentrasi maka semakin banyakmolekulreaktan yang tersedia dengan demikian kemungkinan bertumbukan akan semakin banyak juga sehingga kecepatan reaksi meningkat.
Orde Laju Reaksi
Selanjutnya saya akan menjelaskan wacana orde laju reaksi. Laju reaksi tersebut mempunyai efek konsentrasi reaktan yang besarnya sanggup dinyatakan dengan memakai orde reaksi. Adapun beberapa orde dalam laju reaksi yaitu diantaranya:
-
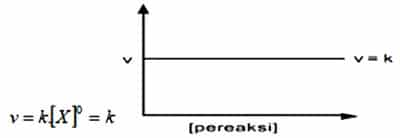
Orde Reaksi Nol
Orde laju reaksi yang pertama ialah orde reaksi nol. Salah satu reaktan yang mempunyai reaksi dengan orde nol, apabila laju reaksi tidak dipengaruhi oleh perubahan konsentrasi reaksinya. Maka dari itu laju reaksi tidak akan terpengaruh terhadap perubahan konsentrasi reaktan meskipun didalamnya berjumlah tertentu. Laju reaksi mempunyai besar yang hanya dipengaruhi oleh besar konstanta laju reaksinya (k).
-
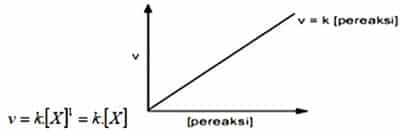
Orde Reaksi Satu
Orde laju reaksi selanjutnya ialah orde reaksi satu. Salah satu reaktan yang mempunyai reaksi dengan orde satu, apabila laju reaksi dengan konsentrasi reaktannya saling berbanding lurus. Apabila dilipat tigakan pada konsentrasi reaktan maka besar laju reaksi akan menjadi lebih besar 3 kali atau menjadi 3¹.
-
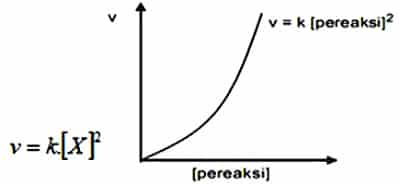
Orde Reksi Dua
Orde laju reaksi selanjutnya ialah orde reaksi dua. Salah satu reaktan yang memilki reaksi dengan orde dua, apabila laju reaksi mempunyai pangkat dua dari konsentrasi reaktan tersebut. Maka apabila dilipat tigakan konsentrasi reaktannya, maka besar laju reaksinya menjadi lebih besar 9 kali atau menjadi 3².
Contoh Soal Laju Reaksi
Diketahui sebuah reaksi senyawa dengan persamaan 2N2O5 → 4NO2 + O2. Tentukan rumus laju reaksinya?
Jawab:
Demikian Penjelasan Materi Tentang Rumus Laju Reaksi: Pengertian, Persamaan, Faktor, Orde dan Contoh Soal
Semoga Materinya Bermanfaat Bagi Siswa-Siswi
The post Laju Reaksi adalah first appeared on PAKDOSEN.CO.ID.
ARTIKEL PILIHAN PEMBACA :
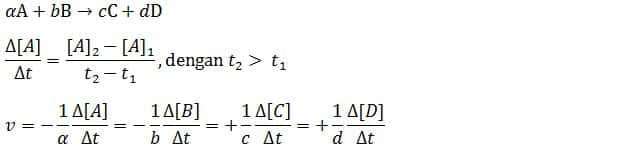

Comments
Post a Comment