Basa-basinya garing ya? hehehe, harap dimaklumi yah, karena admin lagi agak ngantuk, semalam abis begadang di tempat Teteh Yuli yang kemarin baru nyunatin anaknya. Berhubung banyaknya inbok yang masuk menanyakan tentang Kalorimeter Adalah maka dengan sangat senang hati admin akan membahasanya. Nah, sambil seruput kopi, yuk simak ulasan lengkapnya dibawah ini.
Pembabaran Lengkap Kalorimeter Adalah
Selamat datang di Pakdosen.co.id, web digital berbagi ilmu pengetahuan. Kali ini PakDosen akan membahas tentang Kalorimeter? Mungkin anda pernah mendengar kata Kalorimeter? Disini PakDosen membahas secara rinci tentang pengertian, prinsip, jenis, fungsi dan contoh. Simak Penjelasan berikut secara seksama, jangan sampai ketinggalan.
Pengertian Kalorimeter
Kalorimeter merupakan suatu alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam suatu perubahan atau reaksi kimia. Adapun kalor merupakan energi yang berpindah akibat adanya perbedaan suhu. Hukum pertama termodinamika menghubungkan perubahan energi dalam suatu proses termodinamika dengan jumlah kerja yang dilakukan pada sistem dan jumlah kalor yang dipindahkan kesistem. Pada kalorimeter terjadi perubahan energi dari energi listrik menjadi energi kalor sesuai dengan hukum kekekalan energi yang menyatakan energi tidak dapat diciptakan dan energi tidak dapat dimusnahkan.
Prinsip Kerja
Prinsip kerja dari kalorimeter adalah mengalirkan arus listrik pada kumparan kawat penghantar yang dimasukan ke dalam air suling. Pada waktu bergerak dalam kawat penghantar (akibat perbedaan potenial) pembawa muatan bertumbukan dengan atom logam dan kehilangan energi. Akibatnya pembawa muatan bertumbukan dengan kecepatan konstan yang sebanding dengan kuat medan listriknya. Tumbukan oleh pembawa muatan akan menyebabkan logam yang dialiri arus listrik memperoleh energi yaitu energi kalor/panas.
Diketahui bahwa semakin besar nilai tegangan listrik dan arus listrik pada suatu bahan maka tara panas listrik yang dimiliki oleh bahan itu semakin kecil. Kita dapat melihat seolah pengukuran dengan menggunakan arus kecil menghasilkan nilai yang kecil. Hal ini merupakan suatu anggapan yang salah karena dalam pengukuran pertama perubahan suhu yang digunakan sangatlah kecil berbeda dengan data yang menggunakan arus besar. Tapi jika perubahan suhu itu sama besarnya maka yang berarus kecil yang mempunyai tara panas listrik yang besar.
Jenis-jenis Kalorimeter
Beberapa jenis kalorimeter yang sering dipakai antara lain: kalorimeter alumunium, elektrik, gas dan kalorimeter bom. Berikut ini akan di bahas mengenai kalorimeter bom dan kalorimeter sederhana.
Kalorimeter Bom
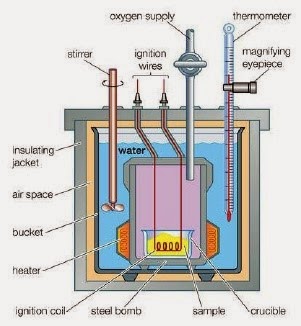
Kalorimeter bom merupakan kalorimeter yang khusus digunakan untuk menentukan kalor dari reaksi-reaksi pembakaran. Kalorimeter ini terdiri dari sebuah bom (tempat berlangsungnya reaksi pembakaran, terbuat dari bahan stainless steel dan diisi dengan gas oksigen pada tekanan tinggi) dan sejumlah air yang dibatasi dengan wadah yang kedap panas. Reaksi pembakaran yang terjadi di dalam bom, akan menghasilkan kalor dan diserap oleh air dan bom. Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka :
qreaksi = –(qair + qbom)
Jumlah kalor yang diserap oleh air dapat dihitung dengan rumus :
qair = m x c x DT
dengan :
m = massa air dalam kalorimeter ( g )
c = kalor jenis air dalam kalorimeter (J / g.oC ) atau ( J / g. K )
DT = perubahan suhu ( oC atau K )
Jumlah kalor yang diserap oleh bom dapat dihitung dengan rumus :
qbom = Cbom x DT
dengan :
Cbom = kapasitas kalor bom ( J / oC ) atau ( J / K )
DT = perubahan suhu ( oC atau K )
Reaksi yang berlangsung pada kalorimeter bom berlangsung pada volume tetap ( DV = nol ). Oleh karena itu, perubahan kalor yang terjadi di dalam sistem = perubahan energi dalamnya.
DE = q + w
Dimana
w = –P.DV (jika DV=nol maka w=nol)
Maka :
DE = qv
Kalorimeter Sederhana
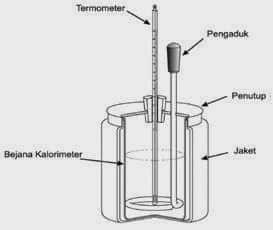
Pengukuran kalor reaksi selain kalor reaksi pembakaran dapat dilakukan dengan menggunakan kalorimeter pada tekanan tetap yaitu dengan kalorimeter sederhana yang dibuat dari gelas stirofoam. Kalorimeter ini biasanya dipakai untuk mengukur kalor reaksi yang reaksinya berlangsung dalam fase larutan (misalnya reaksi netralisasi asam – basa/netralisasi, pelarutan dan pengendapan). Pada kalorimeter ini, kalor reaksi = jumlah kalor yang diserap/dilepaskan larutan sedangkan kalor yang diserap oleh gelas dan lingkungan diabaikan.
qreaksi = – (qlarutan+ qkalorimeter)
qkalorimeter = Ckalorimeter x DT
Dengan :
Ckalorimeter = kapasitas kalor kalorimeter (J/oC) atau (J/K)
DT = perubahan suhu (oC atau K)
Jika harga kapasitas kalor kalorimeter sangat kecil maka dapat diabaikan sehingga perubahan kalor dapat dianggap hanya berakibat pada kenaikan suhu larutan dalam kalorimeter.
qreaksi = –qlarutan
qlarutan = m x c x DT
Dengan :
m = massa larutan dalam kalorimeter ( g )
c = kalor jenis larutan dalam kalorimeter (J / g.oC ) atau ( J / g. K )
DT = perubahan suhu ( oC atau K )
Pada kalorimeter ini, reaksi berlangsung pada tekanan tetap (DP = nol ) sehingga perubahan kalor yang terjadi dalam sistem = perubahan entalpinya.
DH = qp
Suatu benda yang mempunyai suhu lebih tinggi dari fluida bila dicelupkan kedalam fluida, maka benda tersebut akan melepaskan kalor yang akan diserap oleh fluida hingga tercapai keadaan seimbang (suhu benda = suhu fluida).
Fenomena diatas sesuai dengan azas black yang menyatakan bahwa jumlah kalor yang dilepaskan oleh benda sama dengan jumlah kalor yang diserap fluida.
Jika diukur panas jenis benda padat berupa logam dengan menggunakan kalorimeter. mula-mula benda dapat dipanaskan dalam gelas kimia sehingga diasumsikan bahwa tempratur benda sama dengan tempratur uap . Titik didih air tergantung pada tekanan udara dan kemudian menentukan titik didih air berdasarkan tabel yang ada.
massa jenis benda padat dapat dihitung menggunakan persamaan :
mb.Cb.(tb-t2) = (ma.Ca+H) (t2 – t1)
Dimana :
mb = massa benda
Cb = panas jenis benda
tb = temperatur benda mula-mula (setelah dipanaskan)
t1 = temperatur air mula-mula
t2 = temperatur kalorimeter saat keadaan seimbang
ma = massa air
H = harga air kalorimeter
Adapun untuk menentukan massa air mula-mula (Mam) dan massa air setelah dipanaskan (Map) adalah sebagai berikut :
Mam : (Massa kalorimeter + pengaduk + air) – (massa kalorimeter + pengaduk)
Map : (Massa gelas beker + air) – (massa gelas beaker)
Untuk menentukan harga air kalorimeter (H) dapat ditentukan dengan rumus sebagai berikut
H = mb.Cb(tb–t2) = ma.Cb(t2–tb) (t2 – t1)
Keterangan :
mb = massa benda (kg)
Cb = panas jenis benda (J/kg.°K)
tb = suhu setelah dipanaskan (°K)
t2 = suhu saat setimbang (°K)
ma = masa benda mula-mula (kg)
t1 = suhu mula-mula (°K)
H = Harga air kalorimeter
c = 4200 J/kg.k
Didapatkan bahwa kalor merupakan bentuk energi yaitu energi panas. Oleh karena itu pada kalor berlaku hukum setelah energi jika dua buah benda yang suhunya barlainan hukum kekelan energi jika dua buah benda yang suhunya berlainan disentukan atau dicampur, benda yang bersuhu tinggi akan melepaskan kalor dan benda yang bersuhu rendah akan menyerap kalor. Banyaknya kalor yang dilepas sama dengan banyaknya kalor yang diserap. pernyataan ini sesuai dengan pernyataan/azas blask yang menyatakan:
Q lepas = Q terima
Dimana kalor jenis merupakan perbandingan diantara kapasitas panas dengan massa benda
c = Q/(M . ∆t)
Dimana
c = kalor jenis
Q = jumlah kalor
M =massa benda
∆t = perubahan suhu, perubahan suhu ini dapat dicari dengan t2 – t1
Semakin tinggi suatu benda maka semakin rendah massa benda. kapasitas kalor juga disebut harga air (H) atau di sebut juga harga air kalorimeter. harga air kalorimeter dapat ditentukan dengan persamaan rumus yang di dapat melalui persamaan azas black yaitu :
Q lepas = Q terima
mb.Cb(tb–t2) = (ma.Ca+H) (t2–t1)
ma.Ca + H = mb . Cb (tb–t2) (t2–t1)
H = mb.Cb(tb–t2) – ma.Cb(t2–t1)
H = mb.Cb(tb–t2) – ma.Cb(t2–t1) (t2–t1)
Fungsi Kalorimeter
Kalorimeter digunakan untuk menentukan kalori (energi makanan) dalam makanan. Fungsi kalorimeter tergantung pada kekekalan energi dalam sebuah sistem terisolasi tertutup. Dan untuk mengetahui besar energi yang dibebaskan pada suatu sistem menentukan perubahan kalor. Kalorimeter tidak hanya digunakan untuk mengukur kalor jenis bahan logam, melainkan dapat juga digunakan untuk keperluan lain yang berkaitan dengan kalor (jumlah kalor). Beberapa kegunaan kalorimeter yang lain adalah untuk menunjukkan asas Black, mengukur kesetaraan kalor listrik, mengukur kalor lebur es, mengukur kalor uap, dan mengukur kalor jenis cairan.
Contoh Soal dan Pembahasan
Berikut ini adalah beberapa contoh soal kalorimeter beserta pembahasannya yakni sebagai berikut:
1. Didalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (CH4) dengan oksigen berlebihan , sehingga terjadi reaksi,
CH4(g) + 2 O2(g) — CO2(g) + 2H2O (g)
Ternyata terjadi kenaikan suhu 1,56oC . Jika diketahui kapasitas kalor kalorimeter adalah 958 J/oC , massa air didalam kalorimeter adalah 1000 gram dan kalor jenis air 4,18 J/g oC. Tentukanlah kalor pembakaran gas metana dalam kJ/mol. (Ar C = 16, H = 1)
Penyelesaian :
Kalor yang dilepas sistem sama dengan kalor yang diserap oleh air dalam kalorimeter dan oleh klorimeternya, maka
qsistem = qair + q kalorimeter
qair = mair x cair x t
= 1000 g x 4,18 J/g oC x 1,56 oC = 6520 J
qkal = Ckalorimeter x t
= 958 J/oC x 1,56oC
= 1494 J
maka,
qsistem = (6520 + 1494) J
= 8014 J = 8,014 kJ
Jumlah metana yang dibakar adalah 0,16 gram
CH4 = (0,16/16) mol
= 0,01 mol
maka untuk setiap mol CH4 akan dilepas kalor sebanyak
= 801,4 kJ/mol
Karena sistem melepas kalor maka perubahan entalpinya berharga negatif sehingga,
Hc CH4 = – 801, 4 kJ/ mol
2. Dalam suatu kalorimeter direaksikan 100 cm3 larutan NaOH 1 M dengan 100 cm3 larutan HCl 1 M, ternyata suhunya naik dari 250C menjadi 310C. kalor jenis larutan dianggap sama dengan kalor jenis air yaitu 4,18 Jg-1K-1 dan massa jenis larutan dianggap 1 g/cm3. Jika dianggap bahwa kalorimeter tidak menyerap kalor , tentukanlah perubahan entalpi dari reaksi
NaOH (aq) + HCl(aq) NaCl (aq) + H2O (l)
Penyelesaian :
qsistem = qlarutan + qkalorimeter
karena q kalorimeter diabaikan maka
qsistem = qlarutan
massa larutan = m NaOH + m HCl
= (100 + 100) = 200 gram
t = 31 – 25
= 60C
= 6 K
qlarutan = mlarutan x c larutan x t
= 200 gram x 4,18 J gram-1K-1x 6 K
= 5016 Joule
= 5,016 kJ
NaOH = HCl = 0,1 L x 1 mol/L
= 0,1 mol
Jadi pada reaksi antara 0,1 mol NaOH dengan 0,1 mol HCl terjadi perubahan kalor = 5,016 kJ maka untuk setiap 1 mol NaOH bereaksi dengan 1 mol HCl akan terjadi perubahan kalor
= 5,016 kJ/0,1 mol
= 50,16 kJ/mol
Karena pada saat reaksi suhu sistem naik maka berarti reaksinya eksoterm, dan perubahan entalpinya berharga negatif .
Persamaan termokimianya :
NaOH(aq) + HCl (aq) NaCl(aq) + H2O (l) H = – 50,16 kJ
Demikian Penjelasan Materi Tentang Kalorimeter Adalah: Pengertian, Prinsip, Jenis, Fungsi dan Contoh Semoga Materinya Bermanfaat Bagi Siswa-Siswi.
The post Kalorimeter Adalah first appeared on PAKDOSEN.CO.ID.
ARTIKEL PILIHAN PEMBACA :
Comments
Post a Comment